重組單純皰疹病毒(Herpes simplex virus , HSV)是當今富有應用前景的基因治療和腫瘤治療病毒載體�。重組HSV在神經(jīng)系統(tǒng)溶瘤基因轉導和疫苗開發(fā)(針對腫瘤����、HSV以及多種其他疾?�。┓矫嬗兄鴱V泛的應用���。重組HSV具備相當多的優(yōu)點���,如嗜神經(jīng)特性、長潛伏期��、游離體形式存在于整個宿主細胞生命周期以及極大的載體容量���,因此是體內(nèi)和體外基因轉導實驗的理想病毒載體���。
我們的HSV載體經(jīng)過特別設計,可用于重構包括野生型����、減毒型以及復制缺陷型的擴增子形式的一系列HSV活病毒。我們還可以提供科研級和GMP級別的HSV病毒包裝��。
服務詳情
服務類型
我們提供的HSV載體構建和病毒包裝服務如下:
- HSV載體克隆���,使用BAC骨架或者BACYAC骨架
- HSV-1病毒包裝
- HSV-1擴增子載體克隆
HSV BACYAC骨架
云舟生物自主研發(fā)的“BACYAC”骨架專門為HSV載體克隆而設計����。該骨架整合了細菌人工染色體(BAC)和酵母人工染色體(YAC)的關鍵元件�����。BAC相關元件允許該載體可以在大腸桿菌中以BAC形式擴增���,而YAC相關元件允許該載體在釀酒酵母中復制BACYAC載體因此可靈活地在大腸桿菌系統(tǒng)和酵母系統(tǒng)中進行載體擴增和序列修飾���。
BACYAC骨架可以插入LacZ或EGFP報告基因以便于轉染細胞后的識別。骨架上含有一對LoxP位點�����,可在Cre重組酶作用下拼接出最終的病毒基因組序列。
HSV BACYAC載體的基本設計如圖1所示�����。

圖1 含有EGFP和LacZ報告基因的BACYAC骨架
TRL/IRL:長片段側翼的末端和反向重復序列����,通過“a”序列(黑色)重組連接并形成4種異構體。
TRS/IRS:短片段側翼的末端和反向重復序列�,通過“a”序列(黑色)重組連接并形成4種異構體。
UL/US:編碼HSV基因的特殊長片段和短片段���。
UL37/UL38:HSV UL37和UL38基因�。UL37和UL38之間插入外源DNA可引起HSV毒力的微小變化�����。
LoxP:Cre重組酶作用的重組位點�����。兩個LoxP之間的序列可以被Cre重組酶剪切下來���。
EGFP或LacZ報告基因: CMV啟動子驅(qū)動表達的EGFP和LacZ報告基因�����,用于識別轉染成功的細胞�����。
BACYAC骨架:整合了細菌人工染色體(BAC)和酵母人工染色體(YAC)的載體骨架���,可以在大腸桿菌中攜帶氯霉素抗性基因選擇性擴增,也可以在釀酒酵母中使用His3自噬選擇標記進行擴增����。
我們可以構建多種重組HSV BAC載體。此外我們也提供基于BAC修飾原理的HSV突變服務��。對HSV病毒復制相關基因進行序列刪除或點突變可以制備復制缺陷型HSV����;對HSV非關鍵基因進行序列刪除或點突變可以制備減毒型HSV。
HSV擴增子載體
云舟生物的HSV-1擴增子載體包含最小病毒基因組序列:復制起點(oriS)���、包裝信號序列(pac)以及一個或多個目的基因��。通過利用輔助質(zhì)粒(攜帶有整個HSV-1基因組但是無包裝信號序列的BACYAC載體)����,擴增子載體可以包裝出復制缺陷型的但是具備感染能力的HSV病毒顆粒。
HSV擴增子載體的基本設計如圖2所示��。
圖2 HSV-1擴增子載體
Promoter:啟動子序列���,驅(qū)動目的基因表達�。
Kozak:Kozak共有序列��,放置于ORF前端有助于原核細胞中的翻譯起始�����。
ORF:目的基因的開放閱讀框����。
BGH pA: 牛生長激素多聚腺苷酸信號序列(Bovine growth hormone polyadenylation signal)。由啟動子驅(qū)動的轉錄過程將在該序列處終止�����。
HSV-1 pac:HSV-1包裝信號�,在病毒DNA包裝進入病毒顆粒過程中發(fā)揮作用。
Ampicillin:氨芐青霉素抗性基因��。攜帶該基因的質(zhì)粒在E. coli中可以使用氨芐青霉素選擇性擴增。
pUC ori:pUC復制起點���,攜帶該元件的質(zhì)?���?梢栽贓. coli中高拷貝復制����。
oriS:HSV-1 DNA復制起點�����。攜帶該元件的質(zhì)粒以多連體DNA形式包裝進入HSV-1病毒顆粒��。
IE4/5:HSV-1 ICP22和ICP47中早期基因啟動子���。該啟動子的激活取決于順式HSV-1包膜蛋白VP16��。該啟動子可以驅(qū)動下游標記基因表達����,同時也作為激活oriS功能的轉錄調(diào)控序列���。
Marker:標記基因(如EGFP��、LacZ)���,用于分辨轉染成功的細胞
SV40 early pA:猿猴空泡病毒40早期多聚腺苷酸信號序列(Simian vacuolating virus 40 early polyadenylation signal)�,有助于上游ORF序列的轉錄中止�����。
HSV病毒包裝
價格與周期
| 規(guī)格 | 應用 | 滴度 | 體積 | 價格 (CNY) | 周期 |
|---|
| 超純化HSV病毒小量制備 | 細胞培養(yǎng)與體內(nèi)應用 | >107 PFU/ml | 1 ml (10x100 ul) | ¥14,680 | 28-35 天 |
| 超純化HSV病毒中量制備 | >108 PFU/ml | ¥21,680 |
運輸與存儲
我們的HSV病毒保存于HBSS緩沖液��,并以干冰形式運輸�。接收到病毒后,HSV可以在-80°C長期存儲(可至少穩(wěn)定存儲6個月)��,或者在-20°C存儲一周����。HSV的保質(zhì)期約為1年。請避免反復凍融HSV以避免顯著的滴度下降��。
HSV制備與質(zhì)量控制
HSV包裝流程如圖3所示��。攜帶目的基因的BACYAC質(zhì)粒載體與Cre表達質(zhì)粒共轉染包裝細胞。篩選BACYAC骨架移除后的無熒光的噬斑以純化病毒�。然后用篩選后的噬斑進行HSV病毒擴增。對于超純化HSV�����,病毒顆粒經(jīng)過進一步的蔗糖密度梯度離心以獲得純化和濃縮���。
圖3 典型的HSV包裝流程�,使用BACYAC骨架并最終將其移除����。
對于每一個生產(chǎn)的重組HSV病毒����,質(zhì)量控制包括滴度檢測、無菌測試���、支原體檢測等�。如果HSV病毒載體表達熒光蛋白��,則我們會進行熒光轉導測試����。如果HSV病毒載體含有藥篩標記�,我們也會在轉導測試后伴隨進行藥篩測試��。此外��,對于超純化HSV��,我們會進行內(nèi)毒素檢測����。
試驗驗證
我們的HSV載體經(jīng)詳盡驗證可以穩(wěn)定用于生產(chǎn)活病毒。圖4與圖5分別顯示使用我們的BACYAC載體成功包裝出的野生型HSV病毒顆粒以及隨后用其轉導靶細胞的效果�。

圖4 攜帶野生型HSV-1(KOS毒株)全長基因組序列的BACYAC載體(含有EGFP報告基因)轉染BHK21細胞。轉染后72小時進行拍照�。細胞病變效應(Cytopathic effect,CPE)見于紅色箭頭處�����,死細胞發(fā)生團聚并且呈現(xiàn)出球形形態(tài)和反光率增強現(xiàn)象�。這種現(xiàn)象可用于指示活病毒的存在。放大倍數(shù):100X��。左:明場���。右:EGFP����。
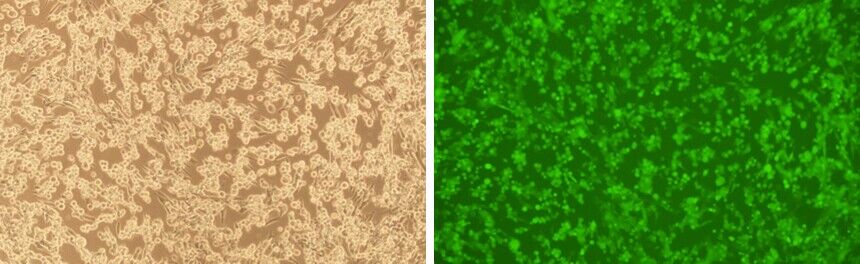
圖5 使用我們生產(chǎn)的HSV病毒顆粒(KOS毒株)轉導BHK21細胞。轉導后96小時進行拍攝�����。放大倍數(shù):100X�。左:明場。右:EGFP����。
HSV在基因治療中的優(yōu)勢
HSV是基因組為雙鏈DNA的包膜病毒,且具備多項應用于基因治療的優(yōu)勢:
廣泛的組織嗜性:HSV可以轉導分裂和非分裂細胞���。HSV同時也是天然的嗜神經(jīng)病毒,可以借助軸突逆行運輸�,因此通過感染注射位點的神經(jīng)末梢即可進行基因遞送。HSV由此也是理想的治療特定神經(jīng)疾病的理想載體�����。
潛伏感染:HSV在神經(jīng)元中長期保持潛伏狀態(tài)�����,不會產(chǎn)生顯著副作用。這種特點讓HSV可以逃避宿主免疫系統(tǒng)并且可以在宿主細胞的生命周期中長期留存���。HSV具有在神經(jīng)元中穩(wěn)定表達目的基因的優(yōu)勢�����,特別是對于那些要求長期表達的研究����。
最小化插入突變風險:當保持潛伏方式感染狀態(tài)時���,HSV以游離體的形式存在����,不整合宿主基因組����,因此最小化了插入突變的風險。
可以使用組織培養(yǎng)基擴增:HSV可以應用組織培養(yǎng)基擴增��,方法簡單且顯示出在多種動物模型形成潛伏感染的能力���。
高病毒滴度:通過包裝獲得的HSV病毒滴度很高����,可以高效轉導靶細胞。
載體容量大:HSV擁有巨大的病毒基因組�,包含超過80個基因,其中一些對于病毒復制是非關鍵的��。這種特點給研究者提供了高度的操作靈活性�,例如可以刪除掉非關鍵基因并利用空間插入大片段或多個目的基因。
常用的HSV載體
HSV載體大致可以劃分為以下幾類:
HSV BAC 載體
HSV BAC載體是通過在真核細胞中使用同源重組方式將BAC骨架插入HSV基因組的方式制備的�����。選擇標記如EGFP有助于正確純化出插入了BAC序列的重組病毒���。皰疹病毒基因組在宿主細胞中傾向于形成環(huán)狀DNA�,并在細胞核內(nèi)部產(chǎn)生復制中間產(chǎn)物�。這些DNA將被分離出來并用以轉化大腸桿菌��。BAC骨架上含有抗生素抗性基因�����,有助于在大腸桿菌中選擇性擴增HSV BAC載體。最后的步驟則是從大腸桿菌中分離出HSV BAC載體���,并使用酶切和測序分析進行質(zhì)檢�。通過質(zhì)檢的HSV BAC載體將被轉染至容許性細胞用于生產(chǎn)活病毒����。
HSV病毒基因組巨大,使用常規(guī)質(zhì)粒載體克隆HSV基因組是不合適的�。BAC載體另一方面由于可以插入大片段DNA序列和較慢的復制速率的特點,因此是HSV研究的更佳選擇�。使用HSV BAC在大腸桿菌中擴增,對比使用容許性細胞擴增臨床分離株的方式更能保障病毒序列的穩(wěn)定性�����。
盡管HSV BAC具備上述所示的多種優(yōu)點��,但是也存在一些不足之處值得考慮��。使用HSV BAC需要首先檢查其序列不含有由于病毒基因組重復序列天然的不穩(wěn)定性造成的突變�����。此外��,插入BAC骨架的HSV基因組造成的病毒基因組大小增加也會抑制病毒生長。因此��,理想的方法是設計HSV BAC載體時在BAC兩側引入loxP或FRT位點�����,允許必要時分別通過Cre-或者Flp-重組系統(tǒng)移除BAC骨架�����。
HSV擴增子載體
擴增子是基于HSV-1的質(zhì)粒載體��,包含一個或多個目的基因以及最小病毒基因組序列����。在HSV-1輔助病毒或者HSV-1基因組克隆提供的順式元件輔助下,擴增子序列可以被包裝進HSV活病毒顆粒�。擴增子只含有兩段病毒序列:一個是oriS復制起點,允許病毒病毒在包裝細胞中復制��;另一個是pac序列��,即包裝信號序列��,在病毒的包裝過程中起作用�����。HSV病毒顆粒組分來自于擴增子基因組��。擴增子使用類似滾環(huán)復制的機制進行復制����,與野生型HSV-1的頭尾相連的多連體DNA相似,最終生成串聯(lián)形式的含有多個擴增子的重復序列����。
擴增子載體具備多種用于基因轉染工具的優(yōu)點,例如極大的載體容量(可達150 kb)�����,易于克隆��,以及可以轉染大量類型的細胞和較高的轉導效率��,此外���,病毒蛋白編碼序列的缺失導致擴增子載體轉染細胞核組織后完全無毒性和無致病性����。缺少病毒基因的擴增子載體同時也可以最小化其被宿主細胞中潛伏的病毒基因組重新激活或發(fā)生序列重組的機會。
長期以來���,使用擴增子進行基因治療的主要瓶頸在于生產(chǎn)高滴度的擴增子病毒時易攜帶有輔助病毒成分�����。被輔助病毒污染的擴增子病毒懸液在應用于基因治療時會導致潛在的細胞毒性和炎癥反應�,因此是不被接受的���。開發(fā)無輔助病毒的包裝系統(tǒng)���,比如使用包含HSV-1基因組但是移除了包裝信號序列的一組重疊的黏粒(Cosmid)或者一個BAC載體來代替輔助病毒用于包裝,能夠很好地克服這種污染問題����。這種方法可以生產(chǎn)出無輔助病毒成分的擴增子病毒懸液,但是制備的病毒滴度并不高�����。另一種方法是����,使用Cre-lox技術在病毒生產(chǎn)細胞中刪除輔助病毒的包裝信號序列�����,從而獲得具備更低輔助病毒污染的高滴度擴增子病毒。然而此種方法仍然包含極低水平的輔助病毒污染�����,可能難以應用于某些特定的基因治療領域��。
HSV載體的主要應用
重組HSV載體在基因治療領域應用多樣�����,主要有以下幾種研究場景:
HSV作為溶瘤病毒
HSV-1在溶瘤病毒療法應用方面�����,由于以下幾個因素而具有相當?shù)臐摿?�。首先HSV-1具有很強感染性��,在10小時內(nèi)即可完成其整個復制周期并釋放數(shù)千個子代病毒顆粒�����,這比腺病毒等其它的常見病毒所需的時間要短得多。除了細胞外擴散外���,HSV-1病毒顆粒還可以通過細胞連接的方式從一個細胞傳導到另一個細胞�,這有利于病毒在實體瘤內(nèi)高效傳播����。此外,HSV-1已被證明可有效感染多種實驗動物��,因此非常適合體內(nèi)臨床前研究�。
經(jīng)過專門設計的減毒HSV溶瘤病毒可以選擇性地在腫瘤細胞中復制并將其殺死,但是不能在正常細胞中生長���。這樣的HSV可以通過刪除正常細胞中病毒復制所必需但對腫瘤細胞不是必需的基因來產(chǎn)生����。此外����,這種HSV的腫瘤殺傷效果還可以通過攜帶抗癌基因或者激活化療試劑的基因來進一步增強。
2015年�����,F(xiàn)DA批準了HSV-1溶瘤病毒藥物Talimogene Laherparepvec(TVEC),目前用于治療黑色素瘤�����。TVEC刪除了病毒基因ICP34.5和ICP47���,使其在正常細胞中無法復制但是可以激活免疫系統(tǒng)。TVEC的溶瘤潛力還因為其過表達人粒細胞巨噬細胞刺激因子(GM-CSF)而得到額外增強�。GM-CSF基因通過增強樹突狀細胞的遷移和成熟來進一步激活免疫系統(tǒng)。
除了減毒病毒載體����,復制缺陷型的HSV也可以用于治療多種癌癥。該方法主要原理是利用復制缺陷型HSV來驅(qū)動細胞自殺基因(例如胸苷激酶)或者其它治療潛力的基因(例如TNF-α)在腫瘤細胞內(nèi)表達從而達到抑制腫瘤生長的目的����。
HSV作為疫苗
HSV在用于抗病毒和抗細菌疫苗研制方面擁有以下幾個優(yōu)勢:1、可用多種途徑給藥激活宿主免疫系統(tǒng)���;2�����、病毒基因組在宿主細胞中保持游離體形式����,不整合宿主基因組; 3��、HSV基因組中表達TK基因可以將無細胞毒性的藥物�,比如Ganciclovir,可以被轉變成有細胞毒性的代謝物以殺死被病毒感染的細胞���,同時不造成副作用�����。實際上��,無論是使用HSV-BAC�、擴增子載體�����、復制缺陷型HSV還是減毒HSV����,在應用于抗擊多種病原體的疫苗時均具有良好的表現(xiàn)�����。
減毒HSV特別適用于開發(fā)抗HSV疫苗�,這是因為它們?yōu)樗拗鞯拿庖呦到y(tǒng)提供了接觸多種類型的病毒抗原的機會����,從而可以激活細胞免疫和體液免疫。此外�����,與非活性疫苗或者僅表達病毒特定亞基的疫苗載體相比���,減毒活疫苗可以提供更長期的有效保護。
此外�����,HSV疫苗的開發(fā)是有一定緊迫性的����,這是因為全世界人口中有很大一部分有感染過HSV-1或HSV-2,但是目前尚未有FDA批準的疫苗可用于治療這兩種病毒�����。VC2是一種在開發(fā)時對病毒糖蛋白gk和膜蛋白UL20進行了部分刪除的減毒活HSV-1病毒,當前已經(jīng)在HSV-1和HSV-2感染的動物模型中測試并表現(xiàn)出良好的應用潛力����。
包含刪除突變的復制缺陷型HSV(刪除了病毒復制所必需的以及表達特異性外來抗原的基因)在作為疫苗注射各種病毒或細菌感染的動物模型中,表現(xiàn)出持久誘導激活免疫反應的特點���。
此外����,在使用小鼠模型的一些臨床前研究中��,擴增子載體作為治療性疫苗已廣泛用于治療癌癥�����、微生物感染以及神經(jīng)疾病�����。當前���,還需要在其他動物模型中評估HSV疫苗的免疫原性�����,包括那些已經(jīng)存在HSV免疫的動物模型��。
HSV作為基因遞送載體
HSV擴增子載體是基于HSV-1設計的�,但是只包含一個或多個目的基因以及最小病毒基因組序列。HSV擴增子載體由于其天然的神經(jīng)嗜性���、極大的裝載能力(可達150 kb)���、低毒性以及在病毒基因組序列在靶細胞內(nèi)以游離體存在的特點,特別適合作為針對神經(jīng)元的進行基因遞送�����。
當前HSV擴增子載體廣泛用于以下領域研究:1���、神經(jīng)退行性疾病,例如阿爾茨海默癥和帕金森疾?。?��、神經(jīng)精神異常���,包括抑郁和上癮���;3�����、治療方法中需要將治療性基因?qū)肷窠?jīng)系統(tǒng)的疾病��,例如缺血性腦卒中�。此外�,由于擴增子載體能夠感染多種分裂細胞系,并且與傳統(tǒng)質(zhì)粒轉染相比�,HSV擴增子載體更容易感染細胞,因此擴增子載體非常適合體外藥理學研究�����。
通過刪除病毒復制所必需的基因以顯著降低細胞毒性�����,復制缺陷型的HSV也是一種基因遞送載體被應用于基因治療�。這些HSV由于多個基因的缺失,其裝載能力也到了提升����,使得它們能夠攜帶多個獨立的基因表達盒���,而這是對用于復合基因治療的載體的典型要求。
因此����,復制缺陷型HSV已廣泛用于多種基因治療研究,包括慢性疼痛�、帕金森疾病、脊髓損傷以及溶酶體儲存障礙等����。NP2是一種表達人前腦啡肽(Preproenkephalin,PENK)的復制缺陷型HSV����,在治療疼痛的一期臨床試驗中顯示出良好的結果。
視頻
HSV病毒在基因治療中的應用
文檔
使用說明書
HSV for In Vitro Applications
HSV for In Vivo Applications
常見問題解答
HSV具有天然的神經(jīng)嗜性,使用擴增子載體時可提供高達150kb的裝載容量���,并且可以在宿主細胞中保持終生的潛伏狀態(tài)���。這種特點讓HSV對比慢病毒、AAV和腺病毒時具有獨特的優(yōu)勢���。此外����,HSV的優(yōu)勢還包括:具有廣泛的宿主細胞感染能力�、在細胞中保持附加體的存在形式不整合宿主基因組、易于在細胞培養(yǎng)基中擴增�、可包裝出高滴度的病毒等。
經(jīng)過大量的試驗測試�,我們提供的HSV BACYAC載體和HSV擴增子載體均可用于生產(chǎn)活HSV病毒�����。HSV BACYAC載體可通過轉染病毒易感的真核細胞(如BHK-21細胞)來生產(chǎn)活病毒。擴增子載體則可以通過與包含失活型HSV-1基因組的BAC共轉染包裝細胞來生產(chǎn)活病毒����。
HSV載體可以在生物安全2級(BSL-2)實驗室進行操作�。但是由于生物安全政策在不同的機構中可能有所差異,我們建議研究者需要根據(jù)自身所處機構的生物安全指引來操作所有病毒載體���。




